Học cỗ môn hoá đi học 11 thì các em đang quá thân quen với dạng bài xích tập nhận thấy các chất, bao giờ thì chất kết tủa, bao giờ thì bay hơi. Bảng tính chảy hoá học tập 11 sẽ giúp các em làm cho được điều đó. Bài viết này để giúp các em nắm vững thông tin nhưng mà bảng tính tan cung cấp, cách để ghi nhớ nhanh và xuất sắc nhất.
Bạn đang xem: Bảng tính tan hóa học 9

Bảng tính tung hoá học tập 11
I. Bảng tính tan hoá học tập 11: Độ tan
Học Ngay từ bây giờ - Hóa Thầy Bình Lớp 11
1. Chất tan và hóa học không tan
- Ví dụ: đến Ca
CO3 và Na
Cl vào cốc nước, thì ta thấy chỉ gồm Na
Cl rã còn Ca
CO3 ko tan.
- bởi vậy gồm chất không tan và bao gồm chất chảy trong nước. Bao gồm chất tan nhiều và có chất tan ít trong nước. Tan những hay ít còn tuỳ vào các loại chất cố gắng thể.
2. Định nghĩa độ tan
- Độ tan là một trong đại lượng đặc thù cho năng lực tan của một hóa học tại một điều kiện nhất định.
- Độ chảy (S) của một hóa học trong nước là số gam chất đó kết hợp trong 100 g nước để tạo thành thành dung dịch bão hòa tại 1 nhiệt độ xác định.
3. Độ tan của một chất trong nước
- giả dụ 100 gam nước hòa tan:
> 10 gam chất tan → hóa học dễ chảy hay hóa học tan nhiều.
4. Những yếu tố ảnh hưởng đến độ tan
Độ tung của một chất dựa vào vào những yếu tố: sức nóng độ, áp suất, thực chất của chất.
- Với chất rắn, phụ thuộc vào vào nhiệt độ độ, thường nhiệt độ tăng thì độ tan tăng.
Ví dụ: khi hoà tan đường vào ly nước nóng con đường sẽ tan nhanh hơn lúc hoà chảy vào cốc nước lạnh.
- Với hóa học khí, lúc tăng ánh nắng mặt trời hoặc bớt áp suất thì độ tan giảm.
5. Ý nghĩa bảng tính tan
Bảng tính tan cho ta biết, độ tan các chất vào nước: chất nào kết tủa, cất cánh hơi, chất tan hay là không tồn trên trong dung dịch. Từ đó ta hoàn toàn có thể làm những bài nhận thấy và những bài toán có kiến thức liên quan.
Bảng tính rã hoá học 11
II. Bảng tính tung hoá học 11: Bảng tính tan
1. Bảng tính rã hoá học 11
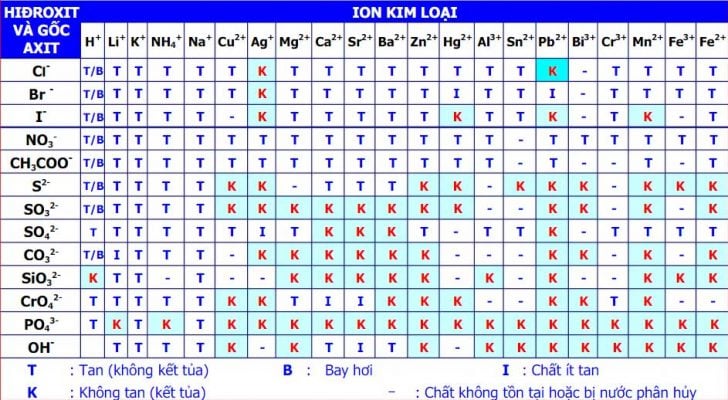
Chú thích:
T: hóa học dễ tan
I: hóa học ít tan
K: chất không tan (ô color xanh)
B: chất bay hơi
- : hóa học không trường tồn hoặc bị nước phân huỷ
Cách hiểu bảng tính tan:
Bảng tính tan gồm các hàng và các cột. Cột là các cation kim loại, còn mặt hàng là những anion nơi bắt đầu axit (hay OH-). Với cùng một chất vắt thể, ta sẽ khẳng định ion dương và ion âm, gióng theo hàng cùng cột khớp ứng ta sẽ hiểu rằng trạng thái của hóa học đó tại một ô.
2. Phương pháp ghi lưu giữ bảng tính tan
Hợp chất | Tính chất | Trừ |
Axit (xem ở cột ion H+ cùng anion gốc axit tương ứng). | Đều tan. | H2Si |
Bazo (xem ở mặt hàng ion OH- và những cation tương ứng). | Không tan. Xem thêm: Nhôm làm lạnh - so sánh tủ đông dàn lạnh bằng đồng và nhôm | Li |
Muối liti Li+ Muối natri Na+ Muối kali K+ Muối amoni NH4+ | Đều tan. | |
Muối bạc Ag+ | Không tung (thường gặp mặt Ag | Ag |
Muối nitrat NO3- Muối axetat CH3COO- | Đều tan. | |
Muối clorua Cl- Muối bromua Br- Muối iotua I- | Đều tan. | Ag Ag Ag Pb |
Muối sunfat SO42- | Đều tan | Ba Ag2SO4: không nhiều tan |
Muối sunfit SO32- Muối cacbonnat CO32- | Không tan | Trừ muối với kim loại kiềm cùng NH4+ |
Muối sunfua S2- | Không tan | Trừ muối bột với sắt kẽm kim loại kiềm, kiềm thổ cùng NH4+ |
Muối photphat PO43- | Không tan | Trừ muối với Na+, K+ với NH4+ |
3. Màu sắc của một số trong những bazơ không tan hay gặp
Bazo | Màu sắc |
Mg(OH)2 | Trắng |
Cu(OH)2 | Xanh lam |
Al(OH)3 | Keo trắng |
Zn(OH)2 | Trắng |
Pb(OH)2 | Trắng |
Cr(OH)3 | Lục xám |
Mn(OH)2 | Hồng nhạt |
Fe(OH)2 | Trắng xanh |
Fe(OH)3 | Nâu đỏ |
Màu của hỗn hợp muối đang theo của ion kim loại.

Bảng tính tan hoá học 11
Bảng tính tan hoá học 11 phức tạp rộng so với bảng tính tan cơ mà ta gặp mặt ở lớp 8 – 9 trước đây. Bảng gồm đến 15 hàng 22 cột chính vì như vậy sẽ bao gồm nhiêu ô với nhiều chất khác nhau nên rất cực nhọc để nhớ tất cả. Do vậy mong mỏi khai thác xuất sắc bảng tính tan thì nên nắm rõ đặc thù của thành phần kết cấu nên hợp chất và vắt mẹo ghi nhớ để xong tốt các bài tập.
Trong môi trường thiên nhiên nước, có những chất hóa học tan vào nước, gồm có chất không tan, cũng có thể có những hóa học tan ít hoặc chảy nhiều. Đây là 1 trong nội dung đặc trưng trong chương tình chất hóa học Lớp 9. Trang rubi trực tuyến xin ra mắt đến các bạn một số nội dung liên quan đến bảng tính tung hóa học cùng cách để nhớ bảng tính tan.
Đặc tính tung trong nước của Axit, Bazơ cùng muối
Các hòa hợp chất khác nhau có công dụng tan khác nhau, tổng vừa lòng chung hoàn toàn có thể rút ra như sau:
Axit: phần lớn các axit số đông tan trong nước, trừ Axit SilicicO3, H4Si
O4,…Bazơ: các bazơ phần nhiều không thể tung trong nước trừ một số trong những hợp hóa học như : KOH, Na
OH… Muối: muối hạt kali, natri phần đông tan; muối hạt nitrat các tan; phần đông muối clorua, sunfat mọi tan được nhưng hầu hết các muối cacbonat phần nhiều không tan.
Mẹo nhỏ: Có bài xích thơ ngắn về tính chất tan như vậy này:
Loại muối bột tan tất cảlà muối ni-tơ-rat
Và muối axetat
Bất kể sắt kẽm kim loại nào.
Những muối hầu như tan
Là clorua, sunfat
Trừ bạc, chì clorua
Bari, chì sunfat.
Những muối không hòa tan
Cacbonat, photphat
Sunfua cùng sunfit
Trừ kiềm, amoni.
Bảng tính tung hóa học
Nắm được bảng tính tan là nội dung đặc biệt trong giải các bài toán hóa học. Ở ánh nắng mặt trời phòng, áp suất 1atm, ta gồm bảng tính tan chất hóa học như sau:
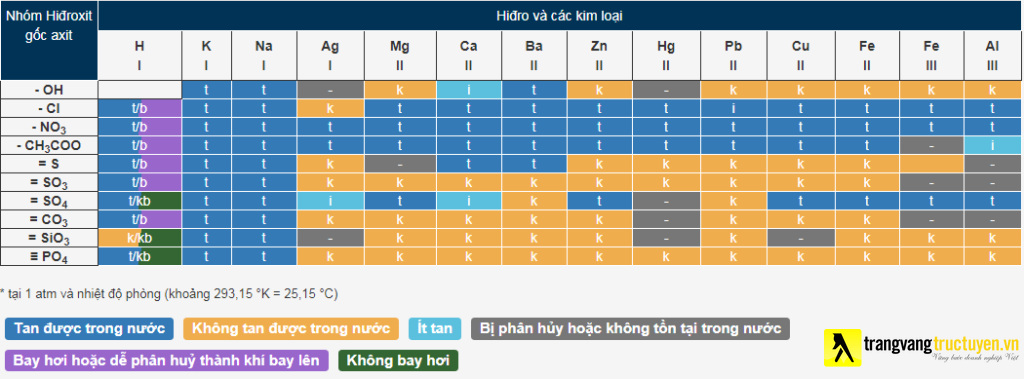
Ở đây: t – tan; k – ko tan; b – cất cánh hơi; i – chảy ít; “-” là hợp chất không sống thọ trong nước.
Mẹo nhỏ: Bài thơ về bảng tính tan
Bazơ, gần như chú ko tan:Đồng, nhôm, crôm, kẽm, mangan, sắt, chìÍt chảy là của canxi
Magie cũng chẳng năng lượng điện li dễ dàng dàng.
Muối sắt kẽm kim loại kiềm đông đảo tan
Cũng như nitrat và “nàng” hữu cơ
Muốn nhớ thì bắt buộc làm thơ!Ta làm cho thí nghiệm bây giờ thử coi,
Kim koại I (IA), ta biết rồi,Những sắt kẽm kim loại khác ta “moi” ra tìm
Photphat vào nước đứng yên (trừ kim loại IA)Sunfat một số “im lìm trơ trơ”:Bari, chì cùng với S-rÍt tan gồm bạc, “chàng khờ” canxi,
Còn muối clorua thì
Bạc đành kết tủa, anh chì cố tan (giống Br- với I-)
Muối không giống thì nhớ dễ dàng dàng:Gốc SO3 chẳng tan chút nào! (trừ kim loại IA)Thế cội S thì sao? (giống muối CO32-)Nhôm không tồn tại, chú nào cũng tan
Trừ đồng, thiếc, bạc, mangan, thuỷ ngân, kẽm, sắt không tan thuộc chì
Đến trên đây thì sẽ đủ thi,Thôi thì chúc chúng ta trường gì rồi cũng vô!
Ngoài ra, chúng ta có thể tham khảo tính chảy của một số muối với hidroxit:
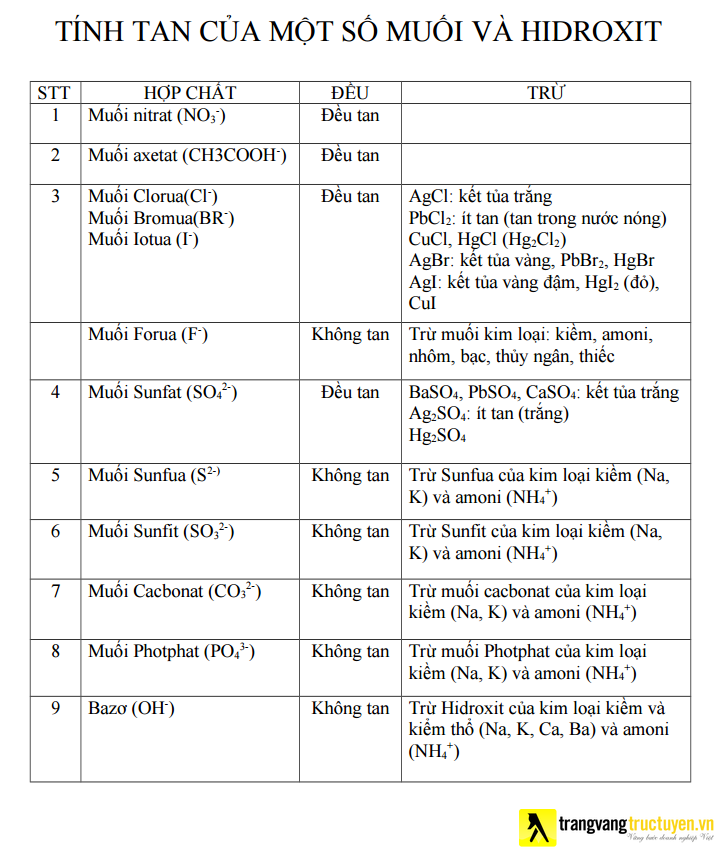
Trên đây, Trang kim cương trực tuyến vừa reviews đến chúng ta bảng tính tan chất hóa học và một trong những mẹo để ghi nhớ. Hy vọng bài viết sẽ hữu dụng trong quy trình học tập!








